Por: Sonia A. Soto-Rodríguez*, Bruno Gómez-Gil, Rodolfo Lozano-Olvera, Karla G. Aguilar-Rendon, Jean Pierre González-Gómez, Cristobal Chaidez
La acuicultura del camarón se enfrenta a brotes bacterianos recurrentes, en particular la necrosis hepatopancreática aguda causada por cepas toxigénicas de vibrios, como Vibrio parahaemolyticus que alberga genes de la toxina PirAB. Los métodos tradicionales de mitigación ofrecen resultados inconsistentes y plantean problemas de sostenibilidad. La terapia con bacteriófagos, que usa virus que atacan y destruyen bacterias, representa una alternativa prometedora y ecológica a las enfermedades bacterianas. Este estudio evalúa la eficacia de un cóctel de fagos durante una infección experimental en Penaeus vannamei.
Introducción
La acuicultura del camarón se enfrenta constatemente a enfernedades bacterianas, en particular la necrosis hepatopancreática aguda (AHPND, por sus siglas en inglés) causada por cepas de Vibrio parahaemolyticus que alberga genes de la toxina PirAB. (Soto-Rodríguez et al., 2022).
Los productores de camarón han utilizado diversos métodos para controlar AHPND en los laboratorios de larvas y durante la enagorda, tales como dietas funcionales, desinfectantes, productos a base de plantas y macroalgas, probióticos y tecnología biofloc. Sin embargo, hoy en día no existen métodos eficaces para controlar esta enfermedad durante los cultivos de camarón.
Las alternativas biológicas, como la terapia de fagos, podrían ayudar a mitigar las devastadoras pérdidas en la industria camaronera y evitar o reducir el uso de agentes antimicrobianos. Los métodos tradicionales ofrecen resultados inconsistentes.
La terapia con bacteriófagos, que son virus que atacan y destruyen bacterias, representa una alternativa biológica a las enfermedades bacterianas. Sin embargo, la aparición de resistencias a los fagos y la complejidad de los ecosistemas microbianos marinos justifican una evaluación cuidadosa. Este estudio evalúa la eficacia de un cóctel de tres fagos durante una infección experimental en Penaeus vannamei, considerando la supervivencia, desarrollo de las etapas de AHPND, cambios microbianos y caracterización genómica.
Métodos
Selección de fagos
Se seleccionaron tres fagos líticos basándose en la especificidad del huesped y bacterias, vB_Pd_PDCC-1 (Veyrand-Quirós et al., 2020), vB_Vc_SrVc9 (Lomelí-Ortega et al., 2021), y vB_Vp_PvVp11 (este estudio). La anotación del genoma confirmó la ausencia de genes de virulencia y resistencia a antibióticos.
Caracterización biológica de los fagos
La actividad lítica y la estabilidad ambiental de los bacteriófagos dirigidos contra V. parahaemolyticus AHPND se evaluaron mediante curvas de crecimiento de un solo paso y crecimiento a diferentes condiciones ambientales. También se evaluó la eficacia de los fagos y parámetros clave como el periodo de latencia y la producción de viriones.
Diseño experimental
Se distribuyeron camarones juveniles (~0,5 g) en cuatro grupos de tratamiento con cinco réplicas:
🗸 Control positivo: infectados con V. parahaemolyticus M0605 (AHPND).
🗸 Terapia de fagos: infectados + cóctel de fagos.
🗸 Control negativo: no infectados.
🗸 Control de fagos: cóctel de fagos sin infección.
La terapia con fagos se administró en una sola dosis por el método de inmersión, antes de la inoculación bacteriana.
Supervivencia e histopatología
La mortalidad se registró constantemente durante 72 horas. Los hepatopáncreas de camarones moribundos se fijaron para su análisis histopatológico y las lesiones se clasificaron de acuerdo a las fases de AHPND.
Muestreo metagenómico
Se colectaron muestras de agua a las 0, 6, 24 y 48 horas postinfección (hpi). Se realizó metagenómica Shotgun utilizando la platafroma Illumina, y posteriormente se realizó el análisis bioinformático.
Resultados y discusión
El fago Vp11 inhibió el crecimiento de V. parahaemolyticus (Figura 1a). El análisis del rango de hospederos mostró que los fagos infectan cepas patógenas de vibrios, incluyendo seis cepas causantes de AHPND. Las pruebas de estabilidad ambiental revelaron cómo la temperatura y la salinidad afectaron la viabilidad de los fagos, los cuales presentaron diversos grados de tolerancia a las condiciones de pruebas de temperatura, salinidad y pH.
Los fagos con la capacidad de producir viriones elevados y periodos de latencia cortos suelen ser más eficaces a la hora de infectar y eliminar especies o grupos bacterianos específicos (Abedon et al., 2001). El fago Vp11 se caracteriza por un buen periodo de latencia de 25 minutos y un tamaño de producción de viriones de 41.3 UFP/célula (Figura 1b).
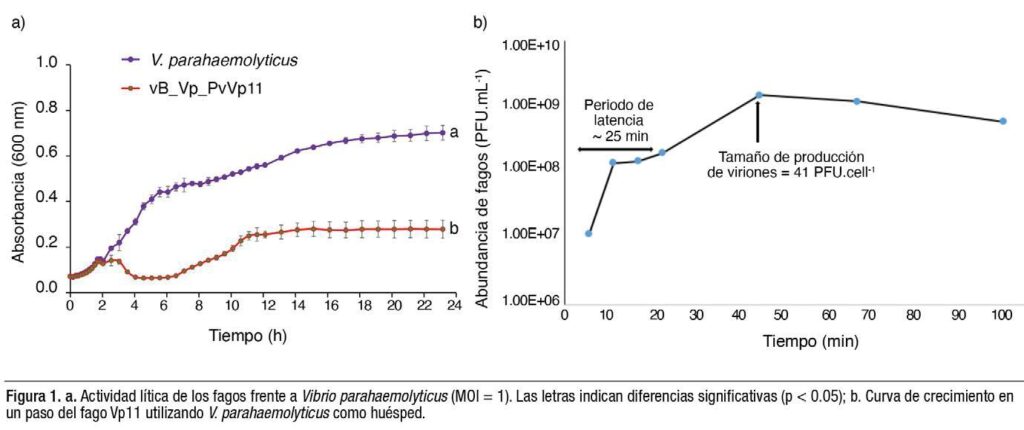
Estos hallazgos ilustran el potencial de estos fagos para destruir especies de Vibrio (vibriófagos), que son patógenos oportunistas críticos.
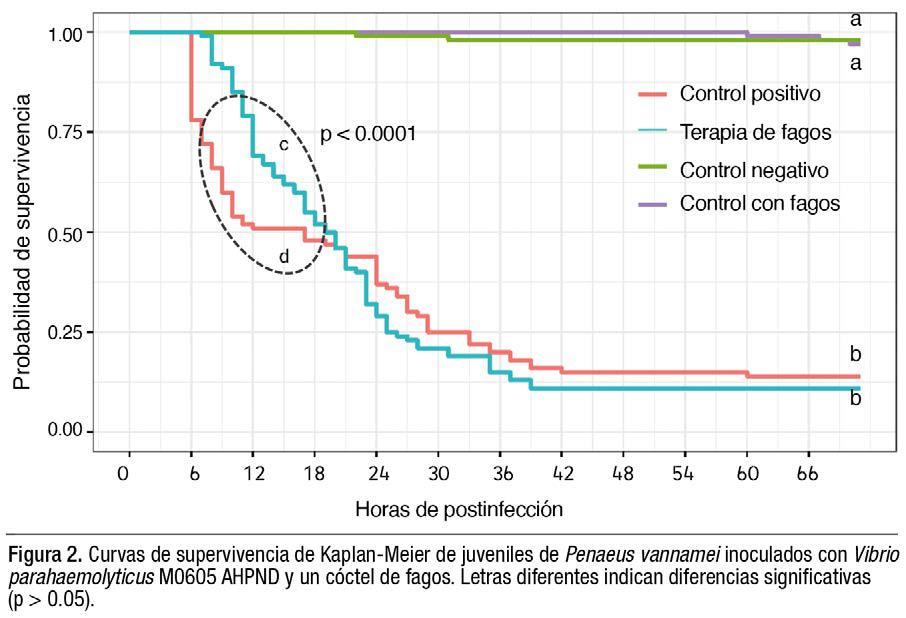
Curvas de supervivencia
La mortalidad aguda se retrasó en los camarones tratados con fagos (muerte inicial a las 8 hpi con respecto a las 12 hrs de los camarones no tratados con fagos) (Figura 2, p < 0.0001), pero la supervivencia a las 72 hpi no difirió significativamente (González-Gómez et al., 2023). Esto indica una protección de los fagos en la etapa aguda de la enfermedad, que es cuando se presenta la mayor mortalidad causada por AHPND.
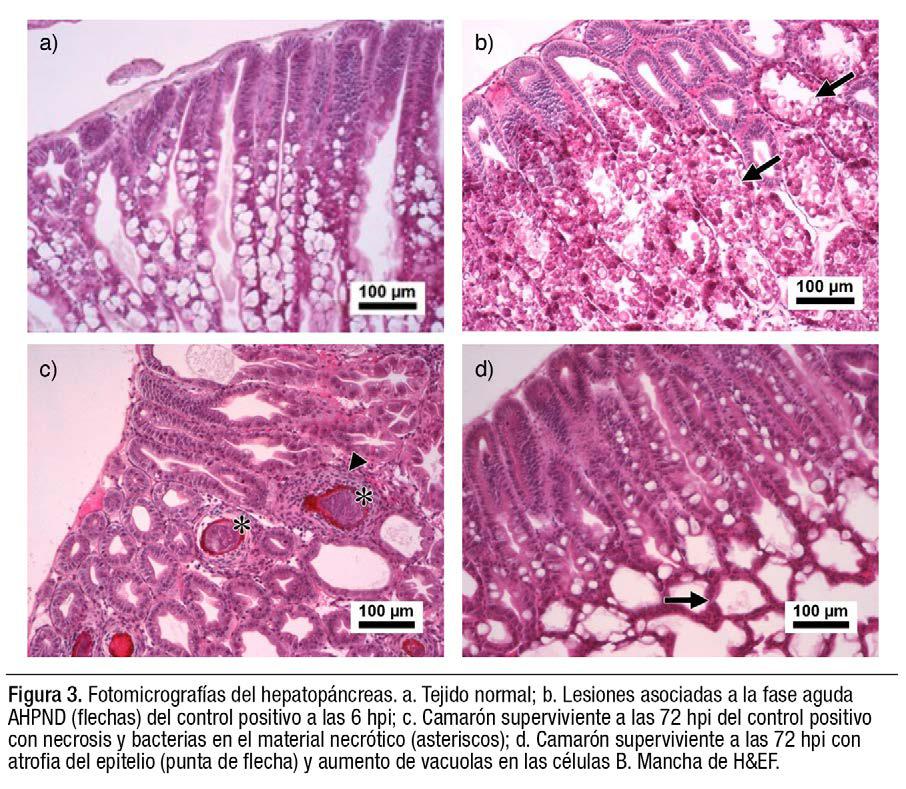
Progresión histológica
Los camarones de ambos grupos infectados (control positivo y terapia de fagos) mostraron lesiones típicas de AHPND, incluyendo desprendimiento masivo de las células epiteliales del hepatopáncreas y vacuolación reducida (Aguilar-Rendón et al., 2020) (Figuras 3a, b). El grupo de terapia de fagos progresó por las etapas más rápidamente, lo que sugiere una resolución acelerada y al mismo tiempo una fase terminal más rápida. En los camarones sobrevivientes fue evidente un menor número de lesiones y una mejor recuperación del hepatopáncreas en los camarones del grupo con terapia de fagos (Figuras 3c, d).
Dinámica de la comunidad microbiana
La diversidad alfa disminuyó significativamente en el agua de los grupos tratados con fagos a las 24 h (índice de Shannon, p < 0.006). El análisis de componentes principales reveló composiciones microbianas distintas, con abundancia de V. parahaemolyticus y bacterias como Ruegeria y Erythrobacter (Dong et al., 2023; Ali et al., 2022).
Conclusión
La terapia con cócteles de fagos demuestra protección contra AHPND durante la fase aguda que es la más crítica de la infección. Los resultados histológicos sugieren la posibilidad de usar dosis adicionales de fagos y respaldan la aplicación de la terapia de fagos como una alternativa sostenible a los antibióticos en la acuicultura de camarones.
La integración de fagos con inhibidores de toxinas y disruptores de quorum sensing puede mejorar las estrategias de control. Los esfuerzos futuros deben centrarse en la optimización de la composición del cóctel, el monitoreo de la resistencia y el análisis del microbioma en los sistemas de cultivo de camarones.
Las referencias y fuentes consultadas por el autor en la elaboración de este artículo están disponibles bajo petición previa a nuestra redacción.
Esta es una versión resumida del artículo “PHAGE COCKTAIL AGAINST VIBRIO PARAHAEMOLYTICUS CAUSING ACUTE HEPATOPANCREATIC NECROSIS DISEASE (AHPND) IN PENAEUS VANNAMEI: GENOMIC, BIOLOGICAL, AND PATHOLOGICAL CHARACTERIZATION” escrito por: SOTO- RODRÍGUEZ, S. – Centro de Investigación en Alimentación y Desarrollo (CIAD), Unidad Mazatlán, QUIROZ-GUZMAN, E. – Centro de Investigaciones Biológicas del Noroeste, GÓMEZ-GIL, B. – CIAD, Unidad Mazatlán, LOZANO-OLVERA, R. -CIAD, Unidad Mazatlán, AGUILAR-RENDON, K. – CIAD, Unidad Mazatlán, SERRANO-HERNÁNDEZ, J.M. – CIAD, Unidad Mazatlán, GONZÁLEZ- GÓMEZ, J.P. – CIAD, Unidad Culiacán, CHAIDEZ, C. – CIAD, Unidad Culiacán.

* Sonia A. Soto-Rodríguez
Centro de Investigación en Alimentación y Desarrollo, A.C. (CIAD), Subsede Mazatlán en Acuicultura y Manejo Ambiental, Av. Sábalo-Cerritos 82112, Mazatlán, México.
Correo electrónico: ssoto@ciad.mx















